Bárbara Scarlett Betancourt Morales
Energía libre de Gibbs
En termodinámica, la energía libre de Gibbs (o energía libre) es un potencial termodinámico, es decir, una función de estado extensiva con unidades de energía, que da la condición de equilibrio y de espontaneidad para una reacción química (a presión y temperatura constantes).
La segunda ley de la termodinámica postula que una reacción química espontánea hace que la entropía del universo aumente, ΔSuniverso > 0, así mismo ΔSuniverso esta en función de ΔSsistema y ΔSalrededores. Por lo general sólo importa lo que ocurre en el sistema en estudio y; por otro lado el cálculo de ΔSalrededores puede ser complicado.
Por esta razón fue necesario otra función termodinámica, la energía libre de Gibbs, que sirva para calcular si una reacción ocurre de forma espontánea tomando en cuenta solo las variables del sistema.
.
Cambios de energía libre estándar
La energía libre de reacción, se denota, , es el cambio de energía en una reacción a condiciones estandares. En esta reacción los reactivos en su estado estandar se convierten en productos en su estado estandar.
, es el cambio de energía en una reacción a condiciones estandares. En esta reacción los reactivos en su estado estandar se convierten en productos en su estado estandar.Dada la siguiente ecuación química:
en general:
Así como en en el cálculo de la entalpía, en la energía libre estándar de formación para cualquier elemento en su forma estable (1 atm y 25ºC) es 0
La variación de energía libre de Gibbs para un proceso a temperatura constante viene dada por:
Significado de 
- La condición de equilibrio es

- La condición de espontaneidad es

- El proceso no es espontáneo cuando:


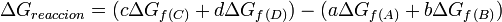







No hay comentarios:
Publicar un comentario