Termodinámica
La segunda ley de la termodinámica o segundo principio de la termodinámica expresa, en una forma concisa, que "La cantidad de entropía de cualquier sistema aislado termodinámicamente tiende a incrementarse con el tiempo". Más sencillamente, cuando una parte de un sistema cerrado interacciona con otra parte, la energía tiende a dividirse por igual, hasta que el sistema alcanza un equilibrio térmico.
En un sentido general, el segundo principio de la termodinámica es la ley de la física que afirma que las diferencias entre un sistema y sus alrededores tienden a igualarse. En un sentido clásico, esto se interpreta como la ley de la física de la que se deriva que las diferencias de presión, densidad y, particularmente, las diferencias de temperatura tienden a igualarse. Esto significa que un sistema aislado llegará a alcanzar una temperatura uniforme. Una máquina térmica es aquella que provee de trabajo eficaz gracias a la diferencia de temperaturas entre dos cuerpos. Dado que cualquier máquina termodinámica requiere una diferencia de temperatura, se deriva pues que ningún trabajo útil puede extraerse de un sistema aislado en equilibrio térmico, esto es, se requerirá de la alimentación de energía del exterior.
El segundo principio se usa a menudo como la razón por la cual no se puede crear una máquina de movimiento perpetuo. En efecto, el segundo principio lleva implícito el establecer la posibilidad de que un determinado fenómeno o proceso, por lo demás consistente con alguna otra ley de la física, pueda en realidad ocurrir. Por ejemplo, podría razonarse que, en virtud del primer principio de la termodinámica, nada impide que, espontáneamente, sea posible extraer calor de un cuerpo frío, por ejemplo a 200K, para transmitírselo a otro caliente, por ejemplo a 1000K: basta con que se cumpla el balance energético correspondiente, a consecuencia del cual el cuerpo frío se enfriaría aun más, y el caliente se calentaría más aun. Sin embargo, el segundo principio establece que tal fenómeno es imposible. Esto no sólo se extiende a fenómenos o procesos físicos o ingenieriles que impliquen algún proceso térmico, sino que el segundo principio se encuentra íntimamente enraizado en todas las ramas de la física: de todas las leyes de la naturaleza, el segundo principio es probablemente uno de los más comprobado, y desde luego el más firmemente reconocido, de manera que se considera como algo indispensable que toda nueva teoría física o todo nuevo fenómeno teorizado, por muchas otras teorías previas a las que contradiga, lo cumpla estrictamente.
Enunciados clásicos
La segunda ley de la termodinámica ha sido expresada de muchas maneras diferentes. Sucintamente, la Termodinámica clásica la ha expresado así:- Es imposible un proceso cuyo único resultado sea la transferencia de energía en forma de calor de un cuerpo de menor temperatura a otro de mayor temperatura. Enunciado de Clausius.
- Es imposible todo proceso cíclico cuyo único resultado sea la absorción de energía en forma de calor procedente de un foco térmico (o reservorio o depósito térmico), y la conversión de toda ésta energía en forma de calor en energía en forma de trabajo. Enunciado de Kelvin-Planck.
- Ningún proceso cíclico es tal que el sistema en el que ocurre y su entorno puedan volver a la vez al mismo estado del que partieron.
- En un sistema aislado, ningún proceso puede ocurrir si a él se asocia una disminución de la entropía total del sistema. Corolario del principio, debido a Clausius.
Matemáticamente, se expresa así:
Entropía de Von Neumann en mecánica cuántica
En el siglo XIX el concepto de entropía fue aplicado a sistemas formados por muchas partículas que se comportan clásicamente, a principios del siglo XX Von Neumann generalizó el concepto de entropía para sistemas de partículas cuánticas, definiendo para un estados mezcla caracterizado por una matriz densidad ρ la entropía cuántica de Von Neumann como la magnitud escalar:Entropía generalizada en Relatividad general
El intento de extender el análisis termodinámico convencional al universo entero, llevó a examinar a principios de los 70 el comportamiento termodinámico de estructuras como los agujeros negros. El resultado preliminar de dicho análisis reveló algo muy interesante, que la segunda ley tal como había sido formulada convencionalmente para sistemas clásicos y cuánticos podría ser violada en presencia de agujeros negros. Sin embargo, los trabajos de Jacob D. Bekenstein sobre teoría de la información y agujeros negros sugirieron que la segunda ley seguiría siendo válida si se introducía una entropía generalizada (Sgen) que sumara a la entropía convencional (Sconv), la entropía atribuible a los agujeros negros que depende del área total (A) de agujeros negros en el universo. Concretamente esta entropía generalizada debe definirse como: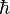 es la constante de Planck racionalizada.
es la constante de Planck racionalizada.


No hay comentarios:
Publicar un comentario