La primera ley no es otra cosa que el principio de conservación de la energía aplicado a un sistema de muchísimas partículas. A cada estado del sistema le corresponde una energía interna U. Cuando el sistema pasa del estado A al estado B, su energía interna cambia en
DU=UB-UASupongamos que el sistema está en el estado A y realiza un trabajo W, expandiéndose. Dicho trabajo mecánico da lugar a un cambio (disminución) de la energía interna de sistema
DU=-W
También podemos cambiar el estado del sistema poniéndolo en contacto térmico con otro sistema a diferente temperatura. Si fluye una cantidad de calor Q del segundo al primero, aumenta su energía interna en
DU=Q
Si el sistema experimenta una transformación cíclica, el cambio en la energía interna es cero, ya que se parte del estado A y se regresa al mismo estado, DU=0. Sin embargo, durante el ciclo el sistema ha efectuado un trabajo, que ha de ser proporcionado por los alrededores en forma de transferencia de calor, para preservar el principio de conservación de la energía, W=Q.
- Si la transformación no es cíclica DU¹ 0
- Si no se realiza trabajo mecánico DU=Q
- Si el sistema está aislado térmicamente DU=-W
- Si el sistema realiza trabajo, U disminuye
- Si se realiza trabajo sobre el sistema, U aumenta
- Si el sistema absorbe calor al ponerlo en contacto térmico con un foco a temperatura superior, U aumenta.
- Si el sistema cede calor al ponerlo en contacto térmico con un foco a una temperatura inferior, U disminuye.
| DU=Q-W |
Transformaciones
La energía interna U del sistema depende únicamente del estado del sistema, en un gas ideal depende solamente de su temperatura. Mientras que la transferencia de calor o el trabajo mecánico dependen del tipo de transformación o camino seguido para ir del estado inicial al final.Isócora o a volumen constante
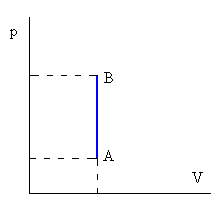 | No hay variación de volumen del gas, luego W=0 Q=ncV(TB-TA) Donde cV es el calor específico a volumen constante |
Isóbara o a presión constante
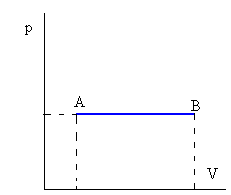 | W=p(vB-vA) Q=ncP(TB-TA) Donde cP es el calor específico a presión constante |
Calores específicos a presión constante cP y a volumen constante cV
En una transformación a volumen constante dU=dQ=ncVdT En una transformación a presión constante dU=ncPdT-pdV Como la variación de energía interna dU no depende del tipo de transformación, sino solamente del estado inicial y del estado final, la segunda ecuación se puede escribir como ncVdT=ncPdT-pdV Empleando la ecuación de estado de un gas ideal pV=nRT, obtenemos la relación entre los calores específicos a presión constante y a volumen constante cV=cP-R Para un gas monoatómicoIsoterma o a temperatura constante
pV=nRT La curva p=cte/V que representa la transformación en un diagrama p-Ves una hipérbola cuyas asíntotas son los ejes coordenados.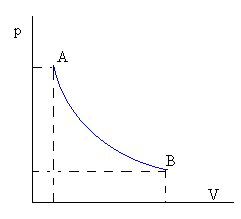 | 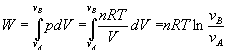 DU=0 DU=0Q=W |
Adiabática o aislada térmicamente, Q=0
La ecuación de una transformación adiabática la hemos obtenido a partir de un modelo simple de gas ideal. Ahora vamos a obtenerla a partir del primer principio de la Termodinámica.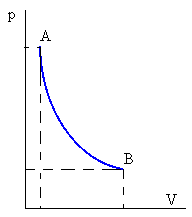 | Ecuación de la transformación adiabática Del primer principio dU=-pdV Integrando 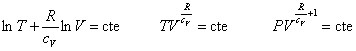 |
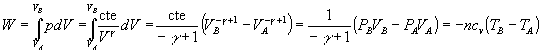 Como podemos comprobar, el trabajo es igual a la variación de energía interna cambiada de signo Si Q=0, entonces W=-DU=-ncV(TB-TA)
Como podemos comprobar, el trabajo es igual a la variación de energía interna cambiada de signo Si Q=0, entonces W=-DU=-ncV(TB-TA) Barbara Betancourt
No hay comentarios:
Publicar un comentario